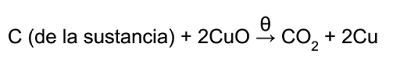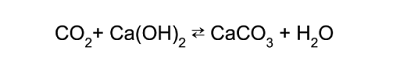El análisis elemental tiene por objeto determinar la clase de elementos que constituyen un compuesto y la proporción en que se los halla. Por eso presenta dos aspectos que se resuelven en forma consecutiva: a) cualitativo; b) cuantitativo.
A veces, previamente, se hacen ensayos de orientación. Por ejemplo, si el compuesto arde en el aire produciendo hollín, podemos suponer que tiene carbono. Lo mismo sucede si al calentarlo en un tubo o cápsula se ennegrece por la separación de carbón.
Si al ser calentada la sustancia produjese olor a pelo quemado, podemos inferir la presencia de nitrógeno entre sus elementos componentes.
Otros ensayos pueden ser: observar si se desprenden gases durante el calentamiento; verificar con un papel de tornasol el carácter ácido o básico de esos gases; etc.
Pero para obtener resultados confiables se utilizan técnicas mas precisas, cuyo fundamento es la mineralización de la sustancia orgánica por medio de una oxidación enérgica. Así se obtienen sustancias inorgánicas fácilmente reconocibles, o iones capaces de producir, con reactivos apropiados, compuestos coloreados identificables.
Los elementos comunes que se buscan en una molécula orgánica son: carbono, hidrógeno, nitrógeno, azufre, fósforo, halógenos.
Fundamento del método
Una sustancias orgánica contiene siempre carbono e hidrógeno (este último salvo unas pocas excepciones). Cuando la sustancia orgánica es calentada con un oxidante fuerte, la molécula orgánica se destruye, transformándose por oxidación el carbono en dióxido de carbono y el hidrógeno en agua:
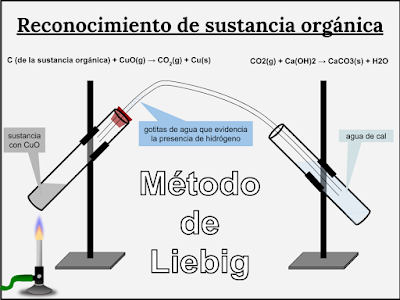
El detalle de esta operación se encuentra en otra sección del blog (haga clic aquí). Explicaremos aquí el método a seguir, llamado método de Liebig.
Como oxidante se utiliza óxido cúprico (negro) en polvo, que deberá estar seco y no contener humedad, por ser el agua una de las sustancias que deben formarse en la reacción. Los fenómenos que ocurren son:
a) transformación del carbono:
b) transformación del hidrógeno:
El dióxido de carbono formado y en estado gaseoso llega, a través de un tubo acodado, a un segundo tubo donde se pone en contacto con una solución de hidróxido de calcio (agua de cal) o de hidróxido de bario, (agua de barita), que son soluciones incoloras.
Por reacción entre el dióxido de carbono y el reactivo mencionado se forma una nueva sustancia sólida blanca, que al permanecer suspendida en la solución la enturbia. Se ha formado un precipitado blanco de carbonato de calcio o carbonato de bario:
o bien:
Puesto que la sustancia analizada no se le ha añadido otra cosa que óxido cúprico, que no contiene carbono, la obtención de un carbonato permite asegurar que el carbono formaba parte de la muestra. Si la sustancia no contuviera carbono (sustancia inorgánica) la reacción hubiese sido negativa.
Simultáneamente con estos fenómenos se observan en la parte superior del primer tubo, relativamente fría, gotitas de un líquido incoloro con todas las características del agua. El reconocimiento del agua también puede hacerse colocando un tapón de lana de vidrio con un poco de sulfato de cobre anhidro (blanco) en la parte alta del tubo. Si se forma agua, ésta hidratará el sulfato de cobre transformándolo en la sal hidratada de sulfato cúprico pentahidratado (azul). El cambio de color revelará la formación de agua y, por consiguiente, se habrá comprobado que la sustancia analizada contenía el hidrógeno necesario para su formación.
En resumen:
 |
| Procesos de reconocimiento de sustancia orgánica |